ชนิดของพันธะ
พันธะภายในโมเลกุล
(intramolecular bond) |
พันธะระหว่างโมเลกุล
(intermolecular bond) |
พันธะโคเวเลนต์ (covalent bonds)
|
พันธะไฮโดรเจน (hydrogen bonds)
|
พันธะไอออนิก (ionic bonds)
|
แรงแวนเดอร์วาลส์
(Van der Waals forces)
|
พันธะโลหะ ( metallic bonds)
|
แรงดึงดูดระหว่างโมเลกุล - ไอออน
(molecule-ion attractions) |
พันธะไอออนิก
พันธะไอออนิก คือ พันธะที่เกิดขึ้นอันเนื่องมาจากแรงดึงดูดทางไฟฟ้าสถิตระหว่างไอออนบวก(cation) และไอออนลบ(anion) อันเนื่องมาจากการถ่ายโอนอิเล็กตรอน จากโลหะให้แก่อโลหะ โดยทั่วไปแล้วพันธะไอออนิกเป็นพันธะที่เกิดขึ้นระหว่างโลหะและอโลหะ ทั้งนี้เนื่องจากว่าโลหะมีค่าพลังงานไอออไนเซชัน(ionization energy)ต่ำ แต่อโลหะมีค่าสัมพรรคภาพอิเล็กตรอน(electron affinity)สูง ดังนั้นโลหะจึงมีแนวโน้มที่จะให้อิเล็กตรอน และอโลหะมีแนวโน้มที่จะรับอิเล็กตรอน
เมื่อโลหะเสียอิเล็กตรอนก็จะกลายเป็นไอออนบวก
อโลหะเมื่อรับอิเล็กตรอนก็จะกลายเป็นไอออนลบ
การเกิดพันธะไอออนิก เกิดระหว่างโลหะกับอโลหะ ยกเว้น Be กับ B โดยโลหะจ่ายอิเล็กตรอนออกไปกลายเป็นประจุบวก อโลหะรับอิเล็กตรอนเข้ามากลายเป็นประจุลบ ประจุบวกและประจุลบที่เกิดขึ้นจะส่งแรงดึงดูดกัน เรียกว่า พันธะไอออนิก
โครงสร้างของสารประกอบไอออนิก
1. ผลึกโซเดียมคลอไรด์ พบว่า ในผลึกโซเดียมคลอไรด์ มีโซเดียมไอออนสลับกันกับคลอไรด์ไอออนเป็นแถว ๆ ทั้งสามมิติ มีลักษณะคล้ายตาข่าย โดยที่แต่ละไอออน จะมีไอออนต่างชนิดล้อมรอบอยู่ 6 ไออออน ดังรูป
ดังนั้นอัตราส่วนระหว่างไอออนบวก : ไอออนลบเท่ากับ 6 : 6 หรือ 1 : 1 สูตรอย่างง่ายจึงเป็น NaCl
2. ผลึกซีเซียมคลอไรด์ แต่ละไอออนจะมีไอออนต่างชนิดล้อมรอบอยู่ 8 ไอออน ดังรูป
สูตรและการอ่านชื่อสารประกอบไอออนิก
เนื่องจากสารประกอบไอออนิกมีลักษณะการสร้างพันธะต่อเนื่องกันเป็นผลึก ไม่ได้อยู่ในลักษณะของโมเลกุลเหมือนในสารประกอบโคเวเลนต์ ดังนั้นสารประกอบไอออนิกจึงไม่มีสูตรโมเลกุลที่แท้จริง แต่จะมีการเขียนสูตรเพื่อแสดงอัตราส่วนอย่างต่ำของจำนวนธาตุต่าง ๆ ที่เป็นองค์ประกอบ เช่น โซเดียมคลอไรด์ เกิดจากอะตอมของธาตุโซเดียม (Na) อย่างน้อยที่สุด 1 อะตอม และอะตอมของธาตุคลอรีน (Cl) อย่างน้อยที่สุด 1 อะตอม จึงสามารถเขียนสูตรได้เป็น NaCl โดยการเขียนสูตรของสารประกอบไอออนิกจะเขียนนำด้วยธาตุที่เกิดเป็นไอออนบวกก่อน จากนั้นจึงเขียนตามด้วยธาตุที่เกิดเป็นไอออนลบตามลำดับ
วิธีการอ่านชื่อสารประกอบไอออนิกให้อ่านตามลำดับของธาตุที่เขียนในสูตร คือ เริ่มจากธาตุแรกซึ่งเกิดเป็นไอออนบวก (ธาตุโลหะ) แล้วตามด้วยธาตุหลังซึ่งเป็นไอออนลบ (ธาตุอโลหะ) ดังนี้
1. เริ่มจากอ่านชื่อไอออนบวก (ธาตุโลหะ) ก่อน
2. อ่านชื่อธาตุไอออนลบ (ธาตุอโลหะ) โดยเปลี่ยนเสียงสุดท้ายเป็น -ไอด์ (-ide) ดังตัวอย่างเช่น
NaCl อ่านว่า โซเดียมคลอไรด์
MgO อ่านว่า แมกนีเซียมออกไซด์
Al2O3 อ่านว่า อะลูมิเนียมออกไซด์
3. หากไอออนลบมีลักษณะเป็นกลุ่มธาตุ จะมีชื่อเรียกเฉพาะที่แตกต่างกัน เช่น No3- เรียกว่า ไนเดรต, CO32- เรียกว่า คาร์บอเนต, SO42- เรียกว่า ซัลเฟต OH- เรียกว่า ไฮดรอกไซด์ เป็นต้น ดังตัวอย่างเช่น
CaCO3 อ่านว่า แคลเซียมคาร์บอเนต
Na2SO4 อ่านว่า โซเดียมซัลเฟต
สารประกอบที่เกิดจากธาตุโลหะอื่นๆ ที่นอกเหนือจากโลหะหมู่ I, II, III รวมกับอนุมูลเดี่ยวและอนุมูลกลุ่ม เนื่องจากธาตุ Transition มีเลข Oxidation หลายค่า ค่าที่นำมาคูณไขว้ในสูตร จะเป็นเลขโรมันบอกไว้ในชื่อนั้นๆอยู่
คอปเปอร์ (II) ซัลเฟต ===> CuSO4
นิกเกิล (III) ออกไซด์ ===> Ni2O3
แมงกานีส (IV) ออกไซด์ ===> MnO2 **
ไอร์ออน (II) ไนเตรต===> Fe(NO3)2
**(เพราะ Mn+4 ส่วน O-2 สามารถหักล้างเลข oxidation ได้)
พลังงานกับการเกิดสารประกอบไอออนิก
สมบัติของสารประกอบไอออนิก
สมบัติของสารประกอบไอออนิก
1. มีขั้ว เพราะสารประกอบไอออนิกไม่ได้เกิดขึ้นเป็นโมเลกุลเดี่ยว แต่จะเป็นของแข็งซึ่งประกอบด้วยไอออนจำนวนมาก ซึ่งยึดเหนี่ยวกันด้วยแรงยึดเหนี่ยวทางไฟฟ้า
2. ไม่นำไฟฟ้าเมื่ออยู่ในสภาพของแข็ง แต่จะนำไฟฟ้าได้เมื่อใส่สารประกอบไอออนิกลงในน้ำ ไอออนจะแยกออกจากกัน ทำให้สารละลายนำไฟฟ้าในทำนองเดียวกันสารประกอบที่หลอมเหลวจะนำไฟฟ้าได้ด้วยเนื่องจากเมื่อหลอมเหลวไอออนจะเป็นอิสระจากกัน เกิดการไหลเวียนอิเล็กตรอนทำให้อิเล็กตรอนเคลื่อนที่จึงเกิดการนำไฟฟ้า
3 . มีจุหลอมเหลวและจุดเดือดสูง ความร้อนในการทำลายแรงดึงดูดระหว่างไอออนให้กลายเป็นของเหลวต้องใช้พลังงานสูง
ตารางแสดงจุดหลอมเหลว และจุดเดือดของสารประกอบไอออนิกบางชนิด
สารประกอบไอออนิก สูตรโมเลกุล จุดหลอมเหลว (๐C) จุดเดือด (๐C)
โซเดียมไฮดรอกไซด์ NaOH 318 1390
โพแทสเซียมไนเดรต KNO3 334 400
แคลเซียมคลอไรด์ CaCl2 772 มากกว่า 1600
โซเดียมคลอไรด์ NaCl 801 1465
อะลูมิเนียมออกไซด์ Al2O3 2054 2980
แมกนีเซียมออกไซด์ MgO 2800 3600
4 . สารประกอบไอออนิกทำให้เกิดปฏิกิริยาไอออนิก คือ ปฏิกิริยาระหว่างไอออนกับไอออน ทั้งนี้เพราะสารไอออนิกจะเป็นไอออนอิสระในสารละลาย ปฏิกิริยาจึงเกิดทันที
5 . สมบัติไม่แสดงทิศทางของพันธะไอออนิก สารประกอบไอออนิกเกิดจากไอออนที่มีประจุตรงกันข้ามรอบ ๆ ไอออนแต่ละไอออนจะมีสนามไฟฟ้าซึ่งไม่มีทิศทาง จึงทำให้เกิดสมบัติไม่แสดงทิศทางของพันธะไอออนิก
6. เป็นผลึกแข็ง แต่เปราะและแตกง่าย
สมการไอออนิก (ionic equation) เมื่อผสมสารละลายของสารไอออนิกแล้วมีตะกอนเกิดขึ้น แสดงว่ามีไอออนรวมตัวกันกลายเป็นสารไอออนิกที่ไม่ละลายน้ำเกิดขึ้น เขียนสมการแสดงการตกตะกอนได้ 3 แบบ คือ

1. สมการโมเลกุล
(molecular
equation) เป็นการเขียน แสดงสารทุกชนิดในรูปโมเลกุล
(หน่วยสูตร) ไม่ต้องแยกออกเป็นไอออน แต่เป็นที่เข้าใจว่าส่วนใดเป็นไอออนบวก ส่วนใดเป็นไอออนลบ
และส่วนใดคือส่วนที่ตกตะกอน
เช่น
Pb(NO3)(aq) + 2KI(aq) → PbI2(s) + 2KNO3(aq)
สารที่มี (aq) อยู่ข้าง ๆ หมายถึงเป็นสารที่แตกตัวเป็นไอออน ซึ่งก็คือสารที่ละลายน้ำได้
สารที่มี (s) อยู่ข้าง ๆ หมายถึงสารที่ตกตะกอน
Pb(NO3)(aq) + 2KI(aq) → PbI2(s) + 2KNO3(aq)
สารที่มี (aq) อยู่ข้าง ๆ หมายถึงเป็นสารที่แตกตัวเป็นไอออน ซึ่งก็คือสารที่ละลายน้ำได้
สารที่มี (s) อยู่ข้าง ๆ หมายถึงสารที่ตกตะกอน
2.
สมการไอออนิกแบบรวม (over all Ionic
equation) เป็นการเขียนแสดงสารแต่ละชนิดเมื่อแตกตัวเป็นไอออน โดยเขียนครบทุกไอออน
เช่น
Pb2+(aq) + 2NO3-(aq) + K+(aq) + 2I- (aq) → PbI2(s) + 2NO3-(aq) + 2K+(aq)
Pb2+(aq) + 2NO3-(aq) + K+(aq) + 2I- (aq) → PbI2(s) + 2NO3-(aq) + 2K+(aq)
ให้สังเกตที่ (aq) และ (s) แสดงการละลายได้และการตกตะกอน ตามลำดับ
3. สมการไอออนิกสุทธิ (net-ionic
equation) กรณีนี้เขียนเฉพาะไอออนที่รวมตัวกันแล้วตกตะกอนเท่านั้น ได้แก่
Pb2+(aq) + 2I- (aq) → PbI2(s)
บางกรณีผสมสารละลายแล้วไม่มีตะกอน แต่พบว่ามีไอออนรวมตัวกัน ก็ให้เขียนสมการไอออนิกจากการรวมตัวของไอออน การที่เรามีความรู้เกี่ยวกับการละลายและการตกตะกอน เมื่อนำสารละลายของสารไอออนิกต่างชนิดมาผสมกันนี้ เราสามารถนำไปใช้ในการเตรียมสารเคมีชนิดใหม่ขึ้นมาได้ โดยการผสมสารเคมีชนิดเดิมที่มีอยู่ เพื่อให้ตกตะกอนเป็นสารเคมีที่ต้องการ เช่น ถ้าเราต้องการเตรียม
BaSO4 ซึ่งเป็นสารไอออนิกที่ไม่ละลายน้ำ เราสามารถเตรียมสารนี้ได้โดยเลือกสารเคมีที่เหมาะสม
2 ชนิด ที่ละลายน้ำได้ สารหนึ่งให้มี Ba2+ เป็นส่วนประกอบ เช่น
BaCl2 อีกสารหนึ่งให้มี SO42- เป็นส่วนประกอบ เช่น
Na2SO4 เมื่อนำมาผสมกันจะตกตะกอนเป็น
BaSO4 ตามต้องการ ดังรูป
ตะกอนสีขาวที่เกิดขึ้นคือ BaSO4 ที่เราต้องการ สำหรับ
Na+ กับ Cl- ยังคงละลายอยู่ในสารละลายตามเดิมเนื่องจากเป็นสารไอออนิกที่ละลายน้ำได้ ถ้าเรากรองแยกเอาตะกอนสีขาวออกมา เราก็จะได้
BaSO4 สำหรับ Na+ กับ Cl- ก็จะไหลผ่านกระดาษกรองไป
เขียนแสดงดังสมการต่อไปนี้
สมการโมเลกุล ;
K2SO4(aq) +
BaCl2(aq) →
BaSO4(s) + 2KCl(aq)
สมการไอออนิกรวม ;
2K+(aq) + SO42-(aq) + Ba2+(aq) + 2Cl-(aq) → BaSO4(s) + 2K+(aq) + 2Cl-(aq)
2K+(aq) + SO42-(aq) + Ba2+(aq) + 2Cl-(aq) → BaSO4(s) + 2K+(aq) + 2Cl-(aq)
สมการไอออนิกสุทธิ ; Ba2+(aq) +
SO42-(aq) →
BaSO4(s)
พันธะโลหะ
พันธะโลหะ หมายถึง แรงยึดเหนี่ยวที่ทำให้อะตอมของโลหะ
อยู่ด้วยกันในก้อนของโลหะ โดยมีการใช้เวเลนต์อิเล็กตรอนร่วมกันของอะตอมของโลหะ โดยที่เวเลนต์อิเล็กตรอนนี้ไม่ได้เป็นของอะตอมหนึ่งอะตอมใดโดยเฉพาะ
เนื่องจากมีการเคลื่อนที่ตลอดเวลา ทุกๆอะตอมของโลหะจะอยู่ติดกันกับอะตอมอื่นๆ
ต่อเนื่องกันไม่มีที่สิ้นสุด จึงทำให้โลหะไม่มีสูตรโมเลกุล
ที่เขียนกันเป็นสูตรอย่างง่าย หรือสัญลักษณ์ของธาตุนั้นเอง
การที่โลหะมีพันธะโลหะจึงทำให้โลหะมีสมบัติทั่วไป ดังนี้
1. โลหะเป็นตัวนำไฟฟ้าที่ดี
เพราะอิเล็กตรอนเคลื่อนที่ได้ง่าย
2. โลหะมีจุดหลอมเหลวสูง
เพราะเวเลนต์อิเล็กตรอนของอะตอมทั้งหมดในก้อนโลหะยึดอะตอมไว้อย่างเหนียวแน่น
3. โลหะสามารถตีแผ่เป็นแผ่นบางๆได้
เพราะมีกลุ่มเวเลนต์อิเล็กตรอนทำหน้าที่ยึดอนุภาคให้เรียงกันไม่ขาดออกจากกัน
4. โลหะมีผิวเป็นมันวาว
เพราะกลุ่มอิเล็กตรอนที่เคลื่อนที่โดยอิสระมีปฏิกิริยาต่อแสง
จึงสะท้อนแสงทำให้มองเห็นเป็นมันวาว
5. สถานะปกติเป็นของแข็ง
ยกเว้น Hg เป็นของเหลว
6. โลหะนำความร้อนได้ดี
เพราะอิเล็กตรอนอิสระเคลื่อนที่ได้ทุกทิศทาง
พันธะโควาเลนต์
พันธะโควาเลนต์ (Covalent bond) หมายถึง
พันธะในสารประกอบที่เกิดขึ้นระหว่างอะตอม 2 อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีใกล้เคียงกันหรือเท่ากัน
แต่ละอะตอมต่างมีความสามารถที่จะดึงอิเล็กตรอนไว้กับตัว
อิเล็กตรอนคู่ร่วมพันธะจึงไม่ได้อยู่ ณ
อะตอมใดอะตอมหนึ่งแล้วเกิดเป็นประจุเหมือนพันธะไอออนิก
หากแต่เหมือนการใช้อิเล็กตรอนร่วมกันระหว่างอะตอมคู่ร่วมพันธะนั้นๆและมีจำนวนอิเล็กตรอนอยู่รอบๆ
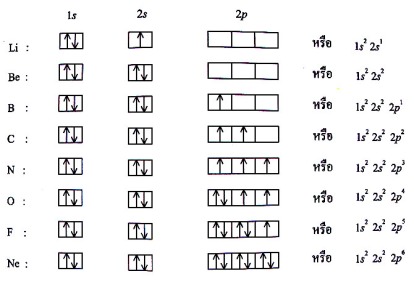
แต่ละอะตอมเป็นไปตามกฎออกเตต ดังภาพ
เป็นพันธะที่เกิดจากการใช้อิเล็กตรอนข้างนอกร่วมกันระหว่างอะตอมของธาตุหนึ่งกับอีกธาตุหนึ่ง
แบ่งเป็น 3 ชนิดด้วยกัน
แบ่งเป็น 3 ชนิดด้วยกัน

1. พันธะเดี่ยว (Single covalent
bond) เกิดจากการใช้อิเล็กตรอนร่วมกัน 1 อิเล็กตรอน เช่น F2 Cl2 CH4 เป็นต้น

2. พันธะคู่ (
Doublecovalent bond ) เกิดจากการใช้อิเล็กตรอนร่วมกันของธาตุทั้งสองเป็นคู่
หรือ 2 อิเล็กตรอน เช่น O2 CO2 C2H4 เป็นต้น

3. พันธะสาม (
Triple covalent bond
) เกิดจากการใช้อิเล็กตรอนร่วมกัน 3 อิเล็กตรอน
ของธาตุทั้งสอง เช่น N2
C2H2 เป็นต้น

การอ่านชื่อสารประกอบโควาเลนซ์
สารประกอบของธาตุคู่
ให้อ่านชื่อธาตุที่อยู่ข้างหน้าก่อน แล้วตามด้วยชื่อธาตุที่อยู่หลัง
โดยเปลี่ยนเสียงพยางค์ท้ายเป็น “ ไอด์” (ide)

ให้ระบุจำนวนอะตอมของแต่ละธาตุด้วยเลขจำนวนในภาษากรีก ดังตาราง
ถ้าสารประกอบนั้นอะตอมของธาตุแรกมีเพียงอะตอมเดียว
ไม่ต้องระบุจำนวนอะตอมของธาตุนั้น
แต่ถ้าเป็นอะตอมของธาตุหลังให้อ่าน “ มอนอ” เสมอ

ประเภทของพันธะโคเวเลนต์
พันธะโคเวเลนต์แบ่งเป็น 2 ประเภท
คือ
1. พันธะโคเวเลนต์แบบไม่มีขั้ว คือพันธะที่เกิดจากอะตอมทั้ง 2 มีการใช้อิเล็กตรอนเท่าๆกัน (มีค่าอิเล็กโทรเนกาติวิตีหรือความสามารถในการดึงดูดอิเล็กตรอนเท่ากัน) และเมื่ออะตอมทั้งสองสร้างพันธะต่อกันแล้วอิเล็กตรอนจะเคลื่อนที่รอบๆและใช้เวลากับอะตอมทั้งสองเท่าๆกัน
1. พันธะโคเวเลนต์แบบไม่มีขั้ว คือพันธะที่เกิดจากอะตอมทั้ง 2 มีการใช้อิเล็กตรอนเท่าๆกัน (มีค่าอิเล็กโทรเนกาติวิตีหรือความสามารถในการดึงดูดอิเล็กตรอนเท่ากัน) และเมื่ออะตอมทั้งสองสร้างพันธะต่อกันแล้วอิเล็กตรอนจะเคลื่อนที่รอบๆและใช้เวลากับอะตอมทั้งสองเท่าๆกัน


.
2. พันธะโคเวเลนต์แบบมีขั้ว อะตอมทั้งสองมีการใช้อิเล็กตรอนร่วมกันแต่ไม่เท่ากัน
นั่นคืออะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูงจะดึงอิเล็กตรอนเข้าหาตัวเองได้มากกว่า
หรืออาจกล่าวได้ว่าเมื่ออะตอมทั้งสองสร้างพันธะต่อกันแล้วอิเล็กตรอนจะเคลื่อนที่รอบๆอะตอมทั้งสองแต่ว่าจะใช้เวลาสำหรับอะตอมทั้งสองไม่เท่ากัน คือจะเกิดประจุลบขึ้นเล็กน้อย (partial negative charge) กับอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูง และประจุบวกขึ้นเล็กน้อย (partial positive charge) กับอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีต่ำกว่า
หรืออาจกล่าวได้ว่าเมื่ออะตอมทั้งสองสร้างพันธะต่อกันแล้วอิเล็กตรอนจะเคลื่อนที่รอบๆอะตอมทั้งสองแต่ว่าจะใช้เวลาสำหรับอะตอมทั้งสองไม่เท่ากัน คือจะเกิดประจุลบขึ้นเล็กน้อย (partial negative charge) กับอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูง และประจุบวกขึ้นเล็กน้อย (partial positive charge) กับอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีต่ำกว่า
สภาพขั้วของโมเลกุลโคเวเลนต์
- โมเลกุลโคเวเลนต์ที่มีพันธะโคเวเลนต์แบบมีขั้ว อาจเป็นโมเลกุลมีขั้วหรือไม่มีขั้วก็ได้
- โมเลกุลโคเวเลนต์มีพันธะโคเวเลนต์แบบไม่มีขั้ว โมเลกุลก็ต้องไม่มีขั้วด้วย
- สภาพขั้วของของโมเลกุลขึ้นอยู่กับผลรวมเวกเตอร์ทางคณิตศาสตร์ของทุกพันธะในโมเลกุล
ถ้าผลรวมเวกเตอร์หักล้างกันหมด (ผลรวมเวกเตอร์เท่ากับศูนย์) แสดงว่าเป็นโมเลกุลไม่มีขั้ว เช่น CO2
- โมเลกุลโคเวเลนต์ที่มีพันธะโคเวเลนต์แบบมีขั้ว อาจเป็นโมเลกุลมีขั้วหรือไม่มีขั้วก็ได้
- โมเลกุลโคเวเลนต์มีพันธะโคเวเลนต์แบบไม่มีขั้ว โมเลกุลก็ต้องไม่มีขั้วด้วย
- สภาพขั้วของของโมเลกุลขึ้นอยู่กับผลรวมเวกเตอร์ทางคณิตศาสตร์ของทุกพันธะในโมเลกุล
ถ้าผลรวมเวกเตอร์หักล้างกันหมด (ผลรวมเวกเตอร์เท่ากับศูนย์) แสดงว่าเป็นโมเลกุลไม่มีขั้ว เช่น CO2
รูปร่างโมเลกุลโคเวเลนต์
รูปร่างโมเลกุลโคเวเลนต์ขึ้นอยู่กับ
ทิศทางของพันธะโคเวเลนต์ , ความยาวพันธะ , และมุมระหว่างพันธะโคเวเลนต์รอบอะตอมกลาง
ทิศทางของพันธะขึ้นอยู่กับ
- แรงผลักระหว่างพันธะรอบอะตอมกลาง
เพื่อให้ห่างกันมากที่สุด
-แรงผลักของอิเล็กตรอนคู่อิสระของอะตอมกลางที่มีต่อพันธะรอบอะตอมกลางแรงนี้มีค่ามากกว่าแรงที่พันธะผลักกันเอง